
Resistencia a la corrosión
Los aceros son los materiales más usados para la fabricación y construcción de equipos.
La naturaleza se resiste a las formas no naturales de la materia, y como venganza reacciona ante ella, provocando lo que podríamos llamar «epidemia», para revertir esta forma no natural del hierro (acero), a su estado natural como óxido de hierro; esta epidemia es conocida como CORROSIÓN.
Los aceros inoxidables son materiales de base hierro (ferrosos), que poseen la propiedad primaria de resistir a la corrosión y se usan bajo severas condiciones de agresividad en donde abundan los agentes de «La epidemia».
Comprender los mecanismos básicos de la corrosión, será de gran ayuda para prevenir el uso del acero inoxidable en condiciones o situaciones que afecten negativamente su desempeño.
La Corrosión
Existen dos formas de corrosión:
Corrosión húmeda (acuosa)
Corrosión seca (gaseosa)
Este artículo comprenderá las formas en que actúa la corrosión húmeda (acuosa), éstas consisten en una o varias de las siguientes formas de ataque:
- Corrosión general
- Corrosión galvánica
- Corrosión por erosión o abrasión
- Corrosión por picados
- Corrosión por cavidades
- Corrosión microbiológica
- Corrosión de fractura bajo tensión
Se piensa algunas veces que estas formas de corrosión afectan únicamente al acero al carbón, pero no es así, los aceros de baja aleación, los aceros inoxidables así como otros metales y aleaciones también sufren formas similares de ataque corrosivo.
CORROSIÓN HÚMEDA (Acuosa)
Consiste en un ataque al metal por sustancias agresivas (los agentes de la epidemia), que por lo general se encuentran disueltas en el agua para formar una solución corrosiva (electrolito). Una película húmeda o polvo que contengan substancias agresivas disueltas, también constituyen un electrolito corrosivo.
La magnitud y severidad de la corrosión dependen de los siguientes factores:
- De la concentración de esas substancias agresivas dentro de la solución corrosiva
- De la temperatura de la solución corrosiva
- De la naturaleza y presencia de los contaminantes, así como de los elementos residuales de la solución.
La concentración
Generalmente es conocida y controlada. Se debe tener cuidado para evitar condiciones en donde la concentración puede variar, por ejemplo:
En la evaporación y condensación
En la concentración en cavidades
Lo que puede causar una corrosión localizada, inesperada o más severa
LA TEMPERATURA
Esta es normalmente conocida y uniforme, pero se debe tener cuidado en prevenir temperaturas altas en zonas localizadas. Un ejemplo típico de esta situación es la que se genera en intercambiadores de calor, por ejemplo: en calentadores solares y calentadores de serpentín. Una fina capa o película de solución corrosiva sobrecalentada se forma sobre la superficie metálica, a través de la cual se transfiere el calor; la temperatura de esta película es la que se debe considerar, ya que es la que produce condiciones más agresivas que la relacionada con la temperatura de la solución.
La presencia y la naturaleza de los contaminantes
Dado que toda corrosión acuosa es electroquímica, existe siempre un equilibrio entre las reacciones de la superficie metálica y las generales en la solución corrosiva. Hasta pequeñas cantidades de residuos contaminantes pueden afectar este balance, ya sea agravando o contrarrestando la severidad de la corrosión.
CORROSIÓN GENERAL
En este tipo de corrosión el ataque es uniforme sobre toda la superficie.
Esta es la forma de corrosión menos peligrosa, pues su velocidad resulta medible y predecible; en consecuencia, dicha corrosión puede ser predeterminada cuando se diseña un equipo para una vida determinada o con un factor de seguridad predeterminado.
Los aceros inoxidables presentan muy bajas velocidades de corrosión general en muchos ambientes altamente agresivos. Esto no significa que sean totalmente inmunes, sino que son materiales de fabricación que ofrecen viables y atractivos costos de ciclo de vida.
En algunas condiciones la superficie metálica puede mostrar señales de manchas, por ejemplo herrumbre visible, rara vez estas manchas son indicadores de velocidades de corrosión similares a las del acero al carbón, que si se dejan originan una pérdida mínima de metal; estas manchas se quitan con un proceso sencillo de limpieza y restaurando la apariencia de la superficie.
Sin embargo, se deberá determinar la causa, especialmente si la mancha café/obscuro es evidente, lo que indica que ha sido rota la capa pasiva.
CORROSIÓN GALVÁNICA
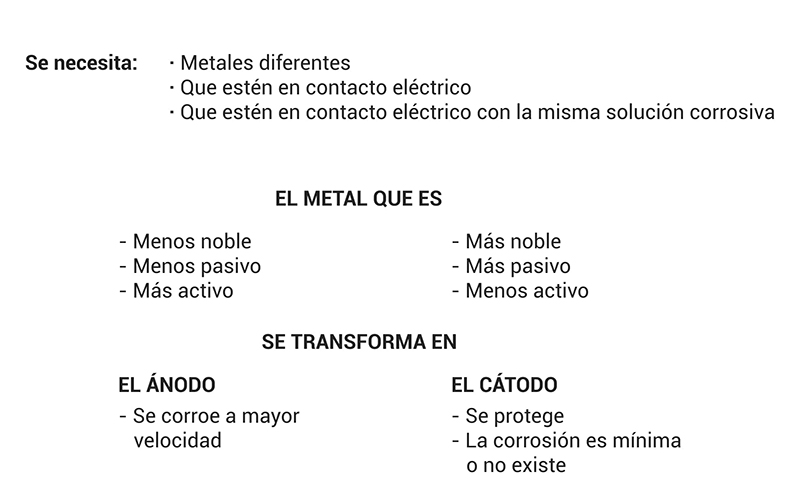
La corrosión galvánica se produce cuando dos metales diferentes están en contacto eléctrico e inmersos en el mismo electrolito (solución corrosiva)
De ambos metales, el menos noble (menos pasivo) y más activo se transforma en el ánodo y se corroe a una velocidad mayor.
A su vez, el más noble (el más pasivo) y el menos activo de ambos metales, se transforma en el cátodo, resultando protegido, corroyéndose a una velocidad menor de la velocidad normal.
La corriente eléctrica que fluye entre los diferentes metales a través de la solución corrosiva, se puede detectar por medio de un voltímetro integrado al circuito.
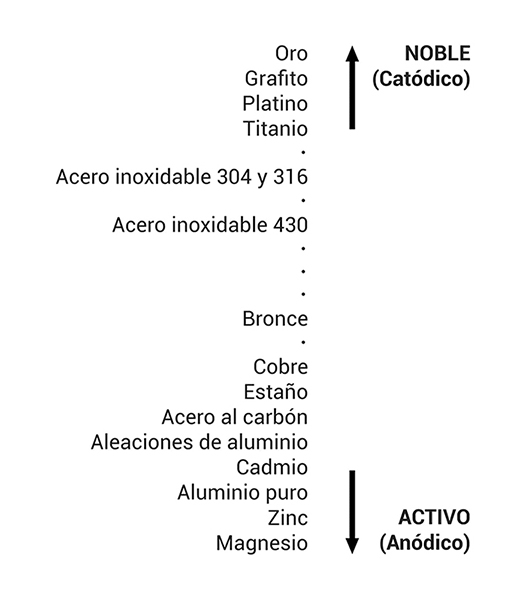
Los metales y aleaciones pueden clasificarse de acuerdo a su grado de actividad (anódicos), o nobleza (catódicos) dentro de un electrolito determinado; esta clasificación es conocida como la serie galvánica de los metales, de la cual la más usada es la serie galvánica en agua de mar.
CORROSIÓN POR EROSIÓN / ABRASIÓN
Esta es una forma mecánica de corrosión. Las partículas abrasivas en suspensión o las altas velocidades de flujo, remueven de la superficie metálica los productos generados por la corrosión que normalmente tienden a separarse, quedando expuesta de esta forma la superficie limpia al ataque corrosivo. Ambos factores actúan simultáneamente y conducen a una pérdida acelerada del metal.
Todos los aceros inoxidables presentan alta resistencia a este tipo de corrosión, debido a la película pasiva estable y resistente, así como a su habilidad de repasivarse. Con frecuencia las alta velocidades resultan benéficas porque aumentan la aireación, la que ayuda a mantener o recuperar la pasividad.
Si las condiciones vuelven metaestable al acero inoxidable, entonces la velocidad de corrosión será similar a la de la corrosión general.
Si la abrasión es alta, la mayor dureza de los aceros inoxidables martensíticos puede resultar la más adecuada, se debe considerar que la corrosión de los aceros inoxidables martensíticos sea adecuada en ese medio.
CORROSIÓN INTERGRANULAR
El carbono (C) tiene una gran afinidad por el cromo (Cr) y bajo determinadas circunstancias, el C se combinará con el Cr para formar un complejo carburo de cromo, esto ocurre principalmente en los aceros inoxidables austeníticos.
Altas temperaturas en el rango de 450ºC a 850ºC generan la formación carburo de cromo, a menores temperaturas el átomo de C carece de movilidad necesaria para combinarse con el Cr. A temperaturas más altas no se forma el carburo de cromo, o si esta presente, inicia su disolución lentamente hasta que se alcanzan temperaturas de ±1050ºC.
La formación de carburo de cromo sucede preferentemente en el borde de grano, en donde una pequeña cantidad de carbono captura una cantidad importante de cromo, pudiendo agotar el Cr en el borde, se dice entonces que el acero se ha sensibilizado.
El borde de grano bajo en cromo, tiene por lo tanto baja resistencia a la corrosión y baja capacidad de pasivación, por lo que son estas áreas las que padecen preferentemente el ataque corrosivo. Este ataque se acelera por el efecto galvánico, en donde los bordes del grano fungen como pequeños ánodos, mientras que el cuerpo del grano más grande hace el papel de cátodo.
De este modo la corrosión avanza a todo lo largo de borde de grano, hasta que los granos son literalmente disueltos y expelidos del metal.
Esta forma de corrosión se presenta frecuentemente al soldar placas de acero inoxidable austenítico. Dentro de la zona afectada por el calor adyacente a una soldadura, hay una área que ha sido calentada dentro del rango de la temperatura de sensibilización y aquí la corrosión intergranular puede ocurrir (desintegración de la soldadura).
Un calentamiento indiscriminado como el que se aplica por ejemplo en operaciones de doblez, puede igualmente tener por resultado la sensibilización y la corrosión intergranular subsecuente.
CORROSIÓN POR PICADOS
Esta es una forma peligrosa de corrosión localizada que produce pequeños hoyos o perforaciones donde hay una pequeña pérdida de metal.
El ion cloro (Cl) es la causa más común de la corrosión por picados y es muy agresivo, móvil y por desgracia muy común. Bajo determinadas condiciones tiene la habilidad de atacar cualquier punto débil localizado en la película pasiva, dando lugar a la formación de microánodos rodeados por un área catódica muy grande, provocando efectos galvánicos muy desfavorables.
Debido a su carga negativa el ion Cl, es muy móvil y fácilmente capturable por cualquier área picada, debido a la carga que se forma en la superficie metálica corroída, concretamente en la base de la picadura. En dicha zona se forma ácido clorhídrico por hidrólisis, que por su gran agresividad actúa como acelerador de la corrosión en esta área.
CORROSIÓN EN HENDIDURAS (Cavidades)
Este tipo de corrosión ataca la superficie metálica, debajo de la cual se encuentra oculta, por ejemplo bajo arandelas o cabezas de tornillo, en las roscas de los tornillos o en accesorios de tubería en contacto con juntas, bajo sedimentos o sólidos asentados, así como bajo flora marina.
Dichas áreas provocan efectos de concentración localizada y soluciones estancadas, que obstaculizan el libre acceso y disponibilidad de oxígeno.
Muchas soluciones acuosas provocan corrosión en las hendiduras,; las mas comunes son las soluciones que contienen iones Cl, porque éste es muy activo y penetra en la hendidura donde aumenta su concentración.
La corrosión en hendiduras y la corrosión por picados se asemejan en cuanto a que, en ambas son atacadas áreas delimitadas, lo que a su vez provoca los efectos galvánicos desfavorables, en los que se presentan pequeños ánodos y grandes cátodos.
CORROSIÓN MICROBIOLÓGICA
Esta forma de corrosión resulta de la actividad microbiológica de las bacterias. Tiene muchos puntos en común con la corrosión en hendiduras, así como con la corrosión por picados. Muchas soluciones acuosas contienen bacterias en abundancia, especialmente en aguas no tratadas de presas naturales, ríos y minas.
Las bacterias son de dos tipos:
Aerobias, son las que requieren un medio ambiente que contenga oxígeno; estas bacterias se encuentran inactivas en la solución acuosa.
Anaerobias, son las que requieren un medio ambiente libre de oxígeno; estas bacterias se encuentran inactivas en la solución acuosa.
Cualquier área de la superficie metálica que atraiga o retenga o retenga a las bacterias aerobias activas, genera una formación de detritus; esta formación, puede llegar a ser lo suficientemente gruesa como para disminuir el nivel de oxígeno debajo de ella, produciendo una situación equivalente a la corrosión en hendiduras.
La insuficiencia de oxígeno debajo de la capa de detritus, permite que las bacterias anaerobias se formen y multipliquen es esta área. Las bacterias anaerobias tienen la propiedad de generar productos metabólicos agresivos que atacan a la película pasiva del acero inoxidable. Debido a la falta de oxígeno, el repasivado se inhibe, produciendo el ataque por picados.
El ataque corrosivo de este tipo, se caracteriza por una leve depresión corroída que contiene algunos picados profundos.
CORROSIÓN DE FRACTURA BAJO TENSIÓN (CFT)
Con frecuencia e injustificadamente los aceros inoxidables austeníticos no son considerados para ciertas aplicaciones debido al temor a este tipo de corrosión.
Para que la CFT tenga lugar, se requiere que coexistan e interrelacionen tres factores:
Esfuerzo de tensión, ya sea aplicado directamente o residual; a mayor esfuerzo mayor condición de peligro; la CFT no sucede bajo condiciones de esfuerzo de compresión.
Temperatura, a mayor temperatura mayor riesgo; la CFT rara vez tiene lugar por debajo de 60ºC.
La presencia de un ión activo, por lo general los halogenuros, siendo el más común el ión cloruro (Cl). Los hidróxidos como la soda cáustica (NaOH) y el sulfuro de hidrógeno (pueden provocar la CFT bajo condiciones de alta temperatura y alta concentración.
A pesar de las investigaciones realizadas en el pasado, así como de las que actualmente se realizan, aún no ha sido posible establecer valores bien determinados que garanticen que debajo de ellos no se produce la CFT inducida por cloruros.
Autor: Budai S.A.

